Enzimas em ação
.
A vida dos microrganismos, como, a de todos os sistemas biológicos, depende de um conjunto de reações que, de forma ordenada, ocorrem em cada instante nas células e constituem o metabolismo celular.
Muitas reações podem ser aceleradas pelo fornecimento de uma certa quantidade de energia ao sistema. Em laboratório, esquecendo o sistema, aumenta a agitação das partículas e ocorrem mais colisões entre elas, iniciando-se mais rapidamente a reação.
A energia que é necessário fornecer ao sistema para se iniciar uma reação química é designada por energia.
https://www.google.com/amp/s/m.biologianet.com/amp/biologia-celular/enzimas.htm.

Nas condições de temperatura e de pressão do meio celular, as moléculas orgânicas são muito estáveis e, portanto, dificilmente reagiriam se não estivessem presentes as numerosas moléculas enzimáticas que catalisam as diversas reaçõeconcretizadas em cada momento num ser vivo.
As enzimas (biocatalisadores ou catalisadores biólogicos) são substâncias orgânicas, usualmente proteínas globulares, que catalisam reações bioquímicas, controlando a sua velocidade.
Nos organismos vivos, as reações não ocorrem ao acaso, fazem geralmente parte de uma via metabólica, ou seja, de uma série de reações ordenadas que ocorrem com intervenção de uma cadeia enzimática, que se inicia com um reagente particular e termina num produto final.

Numa via metabólica, o produto intermédio serve de substrato à reação seguinte, até à formação do produto final. O não funcionamento de uma enzima de cadeia enzimática conduz à acumulação de um dos produtos intermediários, não se formando os produtos seguintes.
Propriedades das enzimas
A sacarose e a maltose são glícidos muito comuns e quimicamente muito próximos que apresentam a mesma fórmula química global.

As leveduras possuem um equipamento enzimático do qual fazem parte as enzimas sacarase e maltase. Estas enzimas, quando em meios de cultura adequados, contendo sacarose e maltose, fazem baixar a energia de ativação, permitindo que as hidrólises dos respectivos glícidos ocorram mais rapidamente. A sacarase é uma enzima exocelular atua fora da célula e a maltase é uma enzima endocelular.
Contrariamente aos catalisadores inorgânicos, as enzimas são específicas tanto em relação ao tipo de reação que catalisam como em relação ao substrato sobre o qual atuam.
Há enzimas, como a sacarase e a maltase, que têm eespecificidade absoluta, atuando cada uma delas somente sobre um substrato, que neste caso, é respetivamente, a sacarose e a maltose. Outras enzimas, como as lipases, têm especificidade relativa, visto que podem atuar sobre um grupo de substâncias com afinidades.
Estrutura das enzimas - interação enzima-substrato
As proteínas enzimáticas são constituídas por uma ou mais cadeias polipeptídicas dobradas, tomando a forma globular. A configuração espacial de uma enzima determina a existência de uma pequena zona designada por centro ativo, que é complementar da configuração espacial do substrato no todo ou em parte. O centro ativo é formado por 3 a 12 aminoácido.
As enzimas, em regra, têm maiores dimensões que os substratos sobre os quais atuam. A ligação entre as duas moléculas que formam o complexo enzima-substrato faz-se na zona do centro ativo.

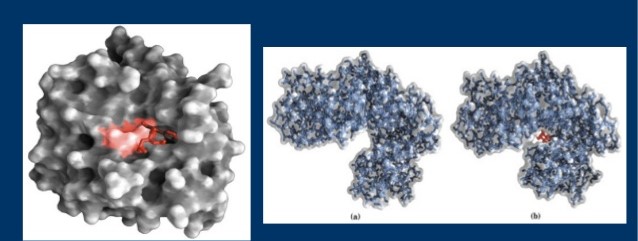
https://www.google.com/amp/s/slideplayer.com.br/amp/10354140/
Inibição da atividade enzimática
Alguns mecanismos de regulação dos sistemas vivos atuam através da inibição da atividade enzimática efetuada por determinadas moléculas.
Inibição irresistível- O inibidor combina-se permanentemente com a enzima, inativando-a ou mesmo destruindo-a. O gás cianídrico e um grande número de pesticidas, como o DDT, são inibidores irreversíveis de enzimas intervenientes na respiração, daí o perigo da sua utilização. Tais inibidores são, pois "venenos metabólicos".
Inibição reversível- O inibidor dissocia-se rapidamente da enzima e a enzima permanece funcional. É o que se verifica no modo como atuam alguns antibióticos. Este tipo de inibição pode ser competitiva ou não competitiva.
Inibição competitiva- Tem uma molécula estruturalmente semelhante ao substrato, mas resistente á ação enzimática, liga-se ao centro ativo da enzima, impedindo a ligação do verdeiro substrato. Assim, o substrato inibidor competem pelo centro ativo.
